Wasser – eines der grundlegenden Stoffe auf unserem Planeten – ist längst nicht immer gleich. Selbst wenn das Wassermolekül H2O stets unverändert bleibt, sind viele verschiedene Substanzen und Spurenelemente in diesem gelöst. So entstehen zahlreiche unterschiedliche Lebensräume. Nicht nur Meerwasser und Süßwasser unterscheiden sich; es gibt zahllose Variationen von Gewässern. Teilweise gibt es selbst innerhalb von Gewässern eines einzigen Landes große Unterschiede in den gelösten Substanzen. Dies ist meist der unterschiedlichen Vegetation sowie der unterschiedlichen Mineralienvorkommen in Quellen- und Gewässernähe geschuldet. Die zahlreichen verschiedenen Gewässer bedingen auch Organismen – sowohl Pflanzen als auch Tiere -, die an diese jeweils speziell angepasst sind. Vor allem in der Aquaristik hat man mit diesem Problem zu kämpfen – es gibt eine schier unerschöpfliche Auswahl von Fischen und Invertebraten. Die individuellen Ansprüche jeder Tierart gilt es zu befriedigen, möchte man möglichst lange Freude an ihnen haben und Zuchterfolge feiern können. Als wenn das nicht schon schwer genug wäre, ist unser Leitungswasser ebenfalls von Ort zu Ort sehr variabel. Nur selten findet man den richtigen Organimus passend zum eigenen Leitungswasser, oft strebt man nach anderen Arten, die einem besser gefallen. Um den Ansprüchen dieser Arten zu genügen, werden oft Möglichkeiten gesucht, das Leitungswasser artgerecht zu verändern. Während einige Aquarianer sich mit einer Mischung aus Osmosewasser und Leitungswasser behelfen können, ist das Leitungswasser bei anderen Personen von den Parametern gänzlich ungeeignet – selbst wenn es verdünnt vorliegt. Das liegt darin, dass das Gleichgewicht von gelösten Substanzen im Vergleich zur Natur verändert ist. Beispielsweise werden weit verbreitete Ionenaustauscher, die hartes Wasser weich machen, mit Kochsalz regeneriert, welches im Endeffekt auch im Wasser landet.
Oft wird dann auf die Chemikalienbox geschielt, um sich ein gutes Wasser zusammenzupanschen, doch meist wird diese Methode für suspekt erachtet und direkt wieder verworfen. Hier soll nun ein kleiner Leitfaden über das Wasserpanschen dargestellt werden. Zuerst wird deutlich gemacht, was einige der Hauptkomponenten von natürlichem Wasser sind – ob sie mit Wassertestsets gemessen werden können oder nicht. Hierbei wird ein Schwerpunkt darauf gelegt, wie die natürlichen Verhältnisse dieser Substanzen zueinander aussehen. Als zweiter Schritt werden einige gängige Substanzen vorgestellt, um Wasserparameter gezielt zu verändern. Zuletzt folgt eine beispielshafte Anleitung, wie man Osmosewasser zu den gewünschten Wasserwerten bringt, ohne dabei die in der Natur vorhandenen Substanzgleichgewichte, an die jeder Organismus angepasst ist, zu vernachlässigen.
Die Wasserwerte
Der pH-Wert, eine dimensionslose Zahl, gibt an, wie viele Wasserstoffionen (H+, Protonen, Oxoniumionen) im Wasser gelöst sind. Ein niedriger pH Wert zeigt viele vorhandene freie Wasserstoffionen, also saures Wasser an. Wenige Wasserstoffionen führen zu einem niedrigen pH-Wert, also zu alkalischem Wasser. Chemikalisch betrachtet ist der pH der negative dekadische Logarithmus der Wasserstoffionenkonzentration.
Der gH-Wert, die Gesamthärte, gibt die Menge an gelösten Erdalkaliionen an. Die wichtigsten Erdalkalimetalle, die die Wasserhärte darstellen, sind Calcium (Ca2+ und Magnesium (Mg2+). Während Strontium und Barium auch die Gesamthärte beeinflussen, sind diese bestenfalls in Spuren in natürlichem Wasser vorhanden.
Der kH-Wert, die Karbonathärte, gibt – wie der Name schon aussagt – die Menge an gelösten Hydrogenkarbonationen (HCO3–) an. Die Karbonathärte dient als Puffer gegen Säuren und Basen, verhindert also abrupte Änderungen des pH-Wertes.
Kalium (K+) ist ein Mineral, welches in den meisten Aquarien Mangelware ist. Vor allem Wassermoose benötigen Kalium zum Biomasseaufbau; Kaliumkonzentrationen von 5 mg/l sind in einem gut bepflanzen Aquarium innerhalb von wenigen Tagen aufgebraucht.
Ammonium(NH3)/Ammoniak(NH4+), Nitrit (NO2–) und Nitrat (NO3–) sind Bestandteile des Stickstoffabbaus. Stickstoff ist ein wichtiger Bestandteil von Eiweißen, welche in jedem Organismus enthalten sind. Die Verdauung von Fischen sowie die bakterielle Zersetzung von organischem Material erzeugt Ammonium oder Ammoniak. Welches der beiden Formen vorhanden ist, ist abhängig vom pH-Wert. Im sauren Milieu (pH < 7) entsteht Ammonium, im basischen Milieu (pH > 7) vorwiegend Ammoniak. Für Wirbellose ist Ammoniak schon in geringen Mengen hochgiftig, Fischen macht es in normalen Konzentrationen (bis zu 0,25 mg/l) wenig aus. Darum sind in Wirbellosenaquarien saure pH-Werte zu empfehlen. Bakterien der Gattung Nitrosomonas, die in jedem Wasser vorhanden sind, verstoffwechseln Ammonium/Ammoniak und produzieren Nitrit (NO2–). Nitrit ist in niedrigsten Konzentrationen (schon ab 0,025 mg/l) hochgiftig für Fische und andere Lebewesen; darum sollten frisch eingerichtete Aquarien nicht mit Tieren besetzt werden. Mit der Zeit und einem vorhandenen Nitritpegel entwickeln sich jedoch auch Bakterien der Gattung Nitrobacter. Diese wandeln das giftige Nitrit in Nitrat(NO3– um. Nitrat ist in normal vorhandenen Konzentrationen (bis zu 50 mg/l für Fische, bis zu 25 mg/l für Garnelen) harmlos und dient als Pflanzennährstoff. Jedoch kann die Nitratkonzentration auch steigen und dadurch einen Wasserwechsel erforderlich machen.
Phosphat (PO4) ist ebenfalls ein Abfallprodukt der Zersetzung von Futter und Organismen. Es dient ebenfalls als Pflanzennährstoff, in hohen Konzentrationen (5-20 mg/l) fördert es jedoch das Algenwachstum. Selbst solche hohen Phosphatwerte sind jedoch meist ungiftig für Fische.
Kupfer (Cu) kann aufgrund von Kupferrohren in neu gebauten Häusern im Wasser gelöst sein. In Altbauten sind die Rohre meistens schon durch eine Kalkschicht vom Wasser isoliert, so dass sich kein Kupfer mehr lösen kann. Für Fische wird Kupfer erst bei hohen Dosen gefährlich, die im Haushalt fast nie erreicht werden. Jedoch reagieren Wirbellose (Schnecken, Garnelen) viel stärker auf Kupfer und können bei kleinen Mengen bereits sterben. Daher sollte vor allem in Wirbellosenaquarien ein besonderes Augenmerk auf Kupfer im Wasser gelegt werden. Kupfer ist auch in einigen Düngemitteln und Fischmedikamenten enthalten, welche in solchen Aquarien gemieden werden sollen.
Eisen (Fe) ist ein wichtiger Pflanzennährstoff. Konzentrationen von über 0,5 mg/l können sich jedoch schädlich auf Fische auswirken. Auch hier kann die genaue Konzentration mit Tröpfchentests bestimmt werden.
Sauerstoff (O2), eines der wichtigsten Gase auf unserer Erde, es wird von fast allen Lebewesen benötigt. Auch im Wasser ist Sauerstoff gelöst, dieses wird durch Sprudelsteine oder einen erhöht angebrachten, sprudelnden Filtereinlauf stetig neu eingebracht. Auch Pflanzen produzieren tagsüber Sauerstoff. Sauerstoffmangel kann bei Überbesatz in zu kleinen Aquarien ohne Wasserbewegung, ohne Pflanzen und/oder faulendem Bodengrund entstehen. Dann sollte auf eine vermehrte Sauerstoffzuleitung geachtet werden.
Kohlenstoffdioxid (CO2) wird von Pflanzen nachts produziert, ist aber tagsüber ein wichtiger Pflanzennährstoff. Fische und ihre Exkremente, die von Bakterien zersetzt werden, produzieren CO2. Das Kohlenstoffdioxid säuert das Wasser aufgrund der Bildung von Kohlensäure (H2CO3)an, wenn es nicht durch Hydrogenkarbonat (kH) gepuffert wird. Wasserbewegung treibt Kohlenstoffdioxid aus dem Aquarium aus.
Alle diese Werte können mit Tröpfchentest anhand von Farbskalen annähernd genau bestimmt werden. Wassertests fehlen jedoch für andere, in jedem Wasser in ebenfalls gleichwertigen Mengen enthaltene Substanzen. Solche sind vor allem Natrium (Na+) und Chlorid (Cl–). Auch als Salz bezeichnet, liegt Naturiumchlorid vor allem im Meer vor. Allerdings gibt es auch Süßgewässer mit erhöhtem Salzgehalt wie zum Beispiel die ostafrikanischen Seen. Der den Tieren zumutbare Salzgehalt sollte auf die Verhältnisse in ihrem Lebensraum abgestimmt sein; ein hoher Salzgehalt ist für Fische aus salzarmen Gewässern mitunter tödlich. Sulfate (SO4) sind für Fische weitgehend harmlos aber auch in zahlreichen Gewässern vorhanden. Auch zahlreiche Spurenelemente werden nicht berücksichtigt. Wie ihr Name allerdings sagt, werden diese kaum in nennenswerten Mengen, sondern maximal in Spuren im Wasser auftreten. Diese Spurenelemente sind beispielsweise in handelsüblichen Pflanzendüngern oder in jedem Leitungswasser in ausreichenden Mengen enthalten.
In den folgenden Tabellen finden sich einige der wichtigsten Wasserwerte von Gewässern rund um die Welt. Die erste Tabelle stellt die absoluten Werte in mg/l dar, die zweite Tabelle die Wasserwerte der Substanzen in Relation zu Calcium (Ca2+), eine der wichtigsten Substanzen im Wasser.
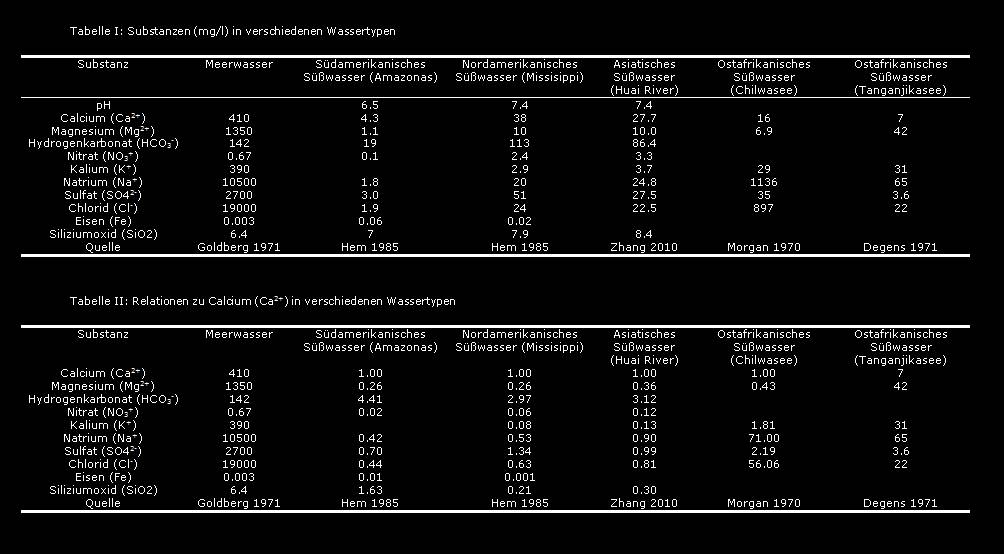
Die große Variabilität dieser Werte zeigt, wie unterschiedlich das Element Wasser rund um den Globus sein kann. Jedoch zeigen unabhängig vom Gewässer die Verhältnisse mancher im Wasser gelösten Substanzen untereinander immer noch feste Regeln.
Die angegebenen Verhältnisse beziehen sich auf das Gewicht der Substanzen, nicht auf die absolute Molekülmenge!
Das Verhältnis Calcium:Magnesium ist meist zwischen 3:1 und 4:1.
Das Verhältnis von Calcium zu Hydrogenkarbonat (d.h. gH ohne Magnesium zu kH) ist meist zwischen 1:3 bis 1:4.
Das Verhältnis von Calcium zu Kalium ist in Süßwasser meist um 10:1.
Das Verhältnis von Calcium zu Chlorid ist meist 2:1.
Das Verhältnis von Calcium zu Sulfat ist ungefähr 1:1.
Diese in der Natur immer wieder anzutreffenden Verhältnisse sollten bei der künstlichen Wasserveränderung stets berücksichtigt werden. Tiere und Pflanzen haben sich nämlich über Jahrmillionen an diese Verhältnisse evolutiv angepasst. Daher kann ein Ungleichgewicht zu schweren Schäden an diesen Organismen führen. Auch kann auch das Algenwachstum durch ein Ungleichgewicht erheblich gefördert werden.
Manipulation der Wasserwerte
Um Wasserwerte gezielt zu manipulieren, werden viele verschiedene Substanzen benutzt. Es folgen einige der gebräuchlichsten Substanzen.
Calciumchlorid (CaCl2) Nebeneffekt: Erhöhung der Chloridkonzentration, pro Calciumion werden zwei Chloridion hinzugefügt (1:2). Das natürliche Verhältnis ist aber 2:1! Nur in Kombination mit anderen Substanzen verwenden!
Calciumsulfat-Dihydrat (CaSO4, gemahlener gegossener Gips; das Gipspulver vor dem Gießen ist Calciumsulfat-Hemihydrat). Schwer wasserlöslich; Nebeneffekt: Erhöhung der Sulfatkonzentration. Da für jedes Calciumion ein Sulfation zugeführt wird, wäre diese Substanz optimal zum aufhärten. Leider aber ist sie so schwer wasserlöslich, dass nur eine sehr begrenzte Menge zugefügt werden kann (2,7 bis 8,8 Gramm pro Liter).
Magnesiumsulfat-Heptahydrat (MgSO4, Bittersalz). Nebeneffekt: Erhöhung der Sulfatkonzentration. Da das natürliche Verhältnis zwischen Magnesium und Sulfat bei 1:3 bis 1:4 liegt, ist eine ausschließliche Magnesiumversorgung über Bittersalz nicht zu empfehlen, auch wenn es gut wasserlöslich ist.
Calciumcarbonat (CaCO3). Sehr schwer wasserlöslich; Nebeneffekt: Erhöhung der Karbonathärte. Für jedes Calciumion entsteht bei Zugabe ein Hydrogenkarbonation. Das natürliche Verhältnis ist allerdings bei 1:3 bis 1:4 zu finden. Darüber hinaus lässt sich diese Substanz extrem schwer in Wasser lösen, nur 14 Milligramm pro Liter sind möglich.
Magnesiumacetat-Tetrahydrat (CH3COO)2 Mg x 4 H2O oder Calciumacetat-Hydrat (CH3COO)2 Ca x H2O. Nebeneffekt: Verbraucht Sauerstoff; Erhöhung der Karbonathärte. Für jedes Magnesiumion werden zwei Moleküle Essigsäure eingebracht. Diese wird von Bakterien unter starkem Sauerstoffverbrauch verstoffwechselt, dabei entsteht nach einer Weile Hydrogenkarbonat. Härtet man nur mit diesen Stoffen Wasser auf, so ist bei ca. 6 gH eine kH von ca. 3 zu erwarten. Auch wenn diese Substanzen sehr gut wasserlöslich ist, ist bei Tierbesatz auf eine ausreichende Sauerstoffversorgung zu achten. Aus diesem Grund sollte nie mehr als 1-2 gH auf einmal aufgehärtet werden, die Tiere könnten sonst aufgrund Sauerstoffmangels ersticken. Calciumacetat-Hydrat ist auch in einigen kommerziellen Produkten wie Shirakura Ca+ enthalten.
Natriumhydrogencarbonat (NaHCO3) oder Kaliumhydrogencarbonat (KHCO3) können dazu verwendet werden, die Karbonathärte anzuheben. Jedoch wird immer zusätzlich damit Natrium oder Kalium eingebracht, was sich in größeren Mengen ungünstig auf die Wasserzusammensetzung auswirken kann. Natrium sollte nur bei salzliebenden Fischen (Zahnkärpflinge, Cichliden) vorhanden sein, für Weichwasserfische ist es ungeeignet. Kalium sollte im Verhältnis zu Hydrogenkarbonat in einem Verhältnis von 1:2 vorliegen.
Kaliumchlorid (KCl) und Magnesiumchlorid (MgCl) lassen sich auch verwenden, allerdings bringen diese gut wasserlöslichen Stoffe auch Chlorid ein, auf dessen Verhältnis in Bezug auf die anderen Substanzen zu achten ist.
Kaliumnitrat (KNO3) und Kaliumphosphat (z.B. K2HPO4) werden zur Erhöhung des Nitrat-(NO3–) oder des Phosphatgehaltes(PO43-) im Sinne der Pflanzendüngung eingesetzt. Es wird zusätzlich Kalium eingetragen, was aber kein Problem ist, da es in den meisten Aquarien Mangelware ist. Beim Einsatz ist – abgeleitet von den natürlichen Wasserwerten, auch als „Redfield-Verhältnis“ bezeichnet – auf ein Verhältnis zwischen Nitrat und Phosphat zu achten. Sonst entstehen Blaualgen oder Grünalgen. Etabliert hat sich ein Verhältnis von einem Zehntel bis zu einem Fünfzehntel an Phosphat im Vergleich zu Nitrat; bezogen auf das Gewicht. Generell wird das Verhältnis 1 – 1/15 empfohlen.
Salzsäure (HCl), Schwefelsäure (H2SO4) oder Phosphorsäure (H3PO4) sind Substanzen, mit denen sich der pH senken lässt. Sie werden auch als „Eichenextrakt“ oder als „pH/kH-Minus“ verkauft. Allerdings wird hierbei je nachdem zusätzlich Chlorid, Sulfat oder Phosphat zugegeben. Alle diese Substanzen wirken sich also über den pH hinaus auf die Wasserzusammensetzung aus. Durch die Reaktion der Säure mit Wasser wird erst die Karbonathärte zerstört, welche als pH-Puffer dient. Anschließend entsteht CO2, welches den pH senkt. Allerdings verflüchtigt sich CO2 durch Wasserbewegung schnell und eine dauerhafte pH-Senkung ist ohne stark schwankende Wasserwerte schwer bis gar nicht zu erreichen. Zur pH-Senkung sind Alternativen wie Torfkanonen (Huminsäuren), Akadama (jap. saurer Lehm) oder eine CO2-Anlage, welche permanent CO2 ins Wasser einbringt, daher besser geeignet.
Bei dieser Vielzahl an Substanzen den Überblick zu behalten, wie viel von welcher Substanz benötigt wird, um die angestrebten Wasserwerte zu erhalten, ist nicht einfach. Daher folgt ein kleiner Exkurs in die Chemie.
Chemie und Zusammenstellung von Substanzen
Ein Mol ist definiert als 6022*1023 Teilchen einer Substanz. Das Gewicht dieser Menge an Teilchen ist durch das Molgewicht der Elemente definiert, das sich in jedem Periodensystem der Elemente neben dem Elementnamen finden lässt. Jede Substanz hat ein eigenes Molgewicht.
Es gilt die Formel:
m(g) = n(mol/l) * M(g/mol)
(Menge der Substanz in g = angestrebte Konzentration in mol/l * Molmasse der Substanz in g/mol)
Ein Grad deutscher Wasserhärte (° dH) entspricht 0,0001783 mol/l Calcium- oder Magnesiumionen. Ein Grad deutscher Karbonathärte(° kH) entspricht 0,00036 mol/l von Hydrogencarbonationen.
Als Beispiel zur Zusammenstellung von Substanzen dient ein Weichwasser, das bei Bienengarnelen zum Einsatz kommt und sehr oft ausgehend von destilliertem Wasser gepanscht wird. Destilliertes Wasser enthält per Definition keine gelösten Substanzen.
Die angestrebten Wasserwerte sind beispielsweise gH 6 und kH 1.
Die Molgewichte der zu verwendenden Substanzen sind:
CaSO4 x ½ H2O (Calciumsulfat-Hemihydrat): 145,12 g/mol
30% des Gewichtes sind Calcium (40,078 g/mol), 70% sind Sulfat (32,066 g/mol + 4 x 15,9994 g/mol).
CaCl2 x 2 H2O (Calciumchlorid-Dihydrat): 147,02 g/mol
36% des Gewichtes sind Calcium (40,078 g/mol), 64% sind Chlorid (35,453 g/mol x 2).
CH3COO)2 Ca x H2O (Calciumacetat-Hydrat): 176,19 g/mol
MgSO4 x 7 H2O (Magnesiumsulfat-Heptahydrat/Bittersalz): 145,12 g/mol
Calciumsulfat:
m = 0.0001783 mol/l * 145,12 g/mol
m = 0.02587 g/l
Von Calciumsulfat-Hemihydrat werden also 0.02587 Gramm pro Liter benötigt, um die Gesamthärte um 1 °dH anzuheben.
Calciumchlorid:
m = 0.0001783 mol/l * 147,02 g/mol
m = 0.02621 g/l
Von Calciumchlorid-Dihydrat werden also 0.02621 Gramm pro Liter benötigt, um die Gesamthärte um 1 °dH anzuheben.
Calciumacetat:
m = 0.0001783 mol/l * 176,19 g/mol
m = 0.03141 g/l
Von Calciumacetat-Hydrat werden also 0.03141 Gramm pro Liter benötigt, um die Gesamthärte um 1 °dH anzuheben.
Magnesiumsulfat:
m = 0.0001783 mol/l * 246,48 g/mol
m = 0.043947 g/l
Von Magnesiumsulfat-Heptahydrat (Bittersalz) werden also 0.043947 Gramm pro Liter benötigt, um die Gesamthärte um 1 °dH anzuheben.
Es ist in diesem Beispiel ein Verhältnis von Calcium:Magnesium 5:1 angestrebt. Von 6 ° dH Gesamthärte muss also 1 °dH mit Magnesiumsulfat erzeugt werden; die restlichen 5 °dH mit den Calcium-Substanzen. Das Verhältnis von Calcium zu Chlorid und Sulfat soll ca. 3:1:1 betragen. Berücksichtigt man die individuellen Gewichtsverhältnisse der Substanzen (siehe oben), so stellt sich heraus, dass gleiche Massenverhältnisse von Calciumsulfat-Calciumchlorid-Calciumacetat dazu benötigt werden. Als Nebeneffekt wird durch das Calciumacetat auch die kH ein wenig angehoben. Jede dieser Substanzen soll die Gesamthärte also um 1,66 °dH anheben.
Multipliziert man die obigen Werte also mit 1 bzw. 1,66, ergeben sich also:
0,042944 g Calciumsulfat-Hemihydrat
0,04350 g Calciumchlorid-Dihydrat
0,05214 g Calciumacetat-Hydrat
0,04395 g Magnesiumsulfat-Heptahydrat
pro Liter Wasser, um eine Gesamthärte von 6°dH und ca. 1 °kH zu erreichen.
Nun geht es um die Pflanzendüngung, d.h. die Versorgung von Becken mit Nitrat und Phosphat. Vor allem in Becken ohne oder mit im Verhältnis zur Wassermenge niedrigen Fischbesatz herrscht generell ein Mangel; vor allem wenn Osmosewasser eingesetzt wird.
Die Molgewichte der zu verwendenden Substanzen sind:
KNO3 (Kaliumnitrat): 101,11 g/mol; davon sind 62,004 g/mol Nitrat (NO3–), also 61,323 % des Gewichtes. 1 mg KNO3 enthält also 0,61323 mg NO3–.
K2HPO4 (Kaliummonohydrogenphosphat): 174,18 g/mol; davon sind 94,97 g/mol Phosphat PO43-, also 54,524 % des Gewichtes. 1 mg K2HPO4 enthält also 0,54524 mg PO43-.
Eine übliche Konzentration in einem Aquarium, die den Pflanzen zuträglich ist, beträgt 10 mg/l Nitrat. Aus dem Verhältnis 15:1 ergibt sich zusätzlich eine benötigte Menge von 0,66 mg/l Phosphat.
1 mg KNO3 = 0,61323 mg NO3–.
1 mg K2HPO4 = 0,54524 mg PO43-.
Über den Dreisatz ergibt sich:
16,3071 mg (0,0163071 g) KNO3 = 10 mg NO3–.
1,2105 mg (0,0012105 g) K2HPO4 = 0,66 mg PO43-.
pro Liter des zu düngenden Wassers.
Eine Multiplikation mit der gewünschten Literzahl ergibt also die benötigten Mengen an Kaliumnitrat und Kaliumphosphat.
Zusätzlich sollten für optimales Pflanzenwachstum mit Hilfe eines handelsüblichen Pflanzendüngers Eisen sowie Spurenelemente zugegeben werden. Hierbei ist eine Dosis zu wählen, die ca. der Hälfte bis einem Viertel der Packungsbeschreibung entspricht; mehr ist Verschwendung. Auch eine CO2-Anlage (z.B. Bio-CO2 mit Paffrath-Schale, leicht für jeden nachzubauen) und eine starke Beleuchtung (0,5 bis 1 Watt pro Liter) sind Vorraussetzung für gutes Pflanzenwachstum ohne Algen.
Die in Aquarien vorkommenden Organismen (vom Bakterium bis zum Fisch) verbrauchen die gelösten Stoffe, also ist auch beim Wasserpanschen ein regelmäßiger Wasserwechsel Pflicht. Dabei sollte allerdings vorher gemessen werden, wie viel von den eingebrachten Substanzen verbraucht wurde, damit die neu eingebrachte Menge an Chemikalien für ein gleich bleibendes Wassermilieu sorgen kann.
Als Beispiel wird hier ein 100 l – Becken herangezogen. In diesem Becken soll eine gH von 6 °dH und ein Nitratwert von 10 mg/l herrschen. Nach einer Woche verändert sich die gH auf 4 °dH und der Nitratwert auf 5 mg/l. Es sollen 30% des Wassers gewechselt werden, also ca. 33 Liter. Osmosewasser soll zum Wasserwechsel benutzt werden.
Um konstante Werte zu gewährleisten ergibt sich dadurch:
33 Liter (Neuwasser) mit 6 °dH Gesamthärte und 10 mg/l Nitrat sowie
66 Liter (Altwasser) mit 2 °dH Gesamthärte und 5 mg/l Nitrat.
Berechnung der nötigen Gesamthärte, die ins Wechselwasser (33 Liter) eingebracht werden muss:
33 x 6° + 66 x 2°, also 198° + 132° = 330°. 330 ° / 33 l = 10 ° dH.
Das Wechselwasser muss also auf 10 °dH aufgehärtet werden, damit im Aquariumwasser wieder überall 6 °dH herrscht.
Berechnung des Nitratgehaltes:
33 x 10 mg + 66 x 5 mg, also 330 + 330 = 660 mg. 660 mg / 33 l = 20 mg/l NO3–.
Das Wechselwasser muss also auf 20 mg/l Nitrat gebracht werden, damit im Aquariumwasser wieder überall 10 mg/l herrscht.
Die benötigten Stoffmengen und Stoffzusammensetzungen für diese Wasserwerte beim Wasserwechsel ergeben sich wie vorher aus den bereits oben vorgestellten Berechnungsschritten. Verdunstet hingegen Wasser im Aquarium, kann einfach destilliertes Wasser nachgefüllt werden, die gelösten Substanzen verbleiben nämlich im Restwasser – der Kalkrand lässt grüßen.
So lässt sich ein für Pflanzen und Tiere optimales Wasser schaffen und aufrecht erhalten.
Viel Spaß beim Wasserpanschen!

